|
GUÍA DE EJERCICIOS QUÍMICA
GENERAL - UNIDAD I
1. De las siguientes sustancias a continuación, identificar: ELEMENTOS,
COMPUESTOS, MEZCLA HOMOGENEA, MEZCLA HETEROGENEA: a) Hierro metálico, b) Azúcar, c) Acero y d) Aire
2. Explique la diferencia entre propiedades de la materia extensivas e intensivas, ejemplifique
3. ¿Qué diferencia hay entre los grupos o familias y los periodos
de la tabla periódica?
4. Nombre tres elementos de transición, un halógeno, un gas noble
y un metal alcalino.
5. Mencione el número de masa de cada uno de los siguientes átomos:
a. Magnesio con 15 neutrones.
b. Titanio con 26 neutrones.
c. Cinc con 32 neutrones.
6. ¿Cuántos electrones, protones y neutrones que contiene un átomo de
24Mg, 119 Sn y 232Th?
7. Llene los sitios vacíos de la tabla (una columna por elemento):
|
Símbolo |
58Ni |
33S |
|
|
|
Nº de Protones |
|
|
10 |
|
|
Nº de Neutrones |
|
|
10 |
30 |
|
Nº de Electrones |
|
|
|
25 |
|
Nombre |
|
|
|
|
8. Diga el número total de átomos de cada elementos en una unidad de formula de cada uno de los siguientes compuestos:
a. CaC2O4
b. C6H5CHO
c. Co(NH3)5(NO2)Cl2
d. K4Fe(CN)6
9. ¿Qué cargas se observan más comúnmente en los iones monoatómicos de los siguientes elementos?
a. Magnesio.
b. Cinc.
c. Níquel.
d. Galio.
10. Mencione el símbolo, incluyendo la carga correcta, de cada uno de los siguiente iones:
a. Ion hidrogeno carbonato
b. Ion Sulfato
c. Ion Cloruro
d. Ion permanganato
11. Proporciones el nombre de cada uno de los siguientes compuestos iónicos:
a. K2S
b. CoSO4
c. Ion bario
d. Ion titanio (IV)
e. Ion fosfato
f. (NH4)3PO4
g. Ca(ClO)2
12. Escriba la formula de cada uno de los siguientes compuestos iónicos:
a. Carbonato de amonio
b. Yoduro de calcio
c. Bromuro de cobre (II)
d. Fosfato de aluminio
e. Permanganato de potasio.
13. ¿Cuál es el nombre de cada uno de los siguientes compuestos binarios no iónicos?
a. NF3
b. HI
c. BI3
d. PF5
14. Proporcione la fórmula de cada uno de los siguientes compuestos binarios no iónicos:
a. Dicloruro de azufre.
b. Pentaóxido de dinitrógeno
c. Tetracloruro de silicio
d. Trióxido de diboro.
15. ¿Qué tiene de incorrecto el modelo de Bohr del átomo?
16. Relacione los valores del l que se muestra en la siguiente
tabla con el tipo de orbital (s, p, d, f) :
|
Valor de l |
Tipo de orbital |
|
3 |
|
|
1 |
|
|
0 |
|
|
2 |
|
17. Números cuánticos:
a. Cuales son los valores posibles de l cuando n = 4.
b. Cuando l=2, ¿Cuáles son los valores de ml?
c. Para un orbital 4s, ¿Cuál son los posibles valores de n, l, ml?
d. Para un orbital 4f, ¿Cuál son los posibles valores
de n, l, ml?
18. Explique brevemente por qué cada una de los siguientes no constituyen
un conjunto de números cuánticos para un electro de un átomo.
a. n=2, l=2, ml=0.
b. n=3, l=0, ml=-2.
c. n=6, l=0, ml=1
19. ¿Cuántas subcapas tiene las capa electrónica con número cuántico
principal n=5?
20. Escriba las configuraciones electrónicas, empleando tanto la notación spdf
como los diagramas de cajas. Describa la relación entre la configuración
electrónica de los átomos y su posición en la tabla periódica. Para los siguientes elementos:
a. P
b. Cl
c. Mg
d. Ar
e. Cr
21. Empleando el diagrama de cajas de orbitales ilustre la configuración electrónica de cada uno de los siguientes
iones:
a. Mg2+
b. K+
c. Cl-
d. O2-
22. Ordene los siguientes elementos de menor a mayor tamaño: Al, B, C, K, Na.
23. De cada una
de las siguientes parejas, elija el átomo o ión que tenga el mayor radio atómico.
a. Cl o Cl-
b. Al o O
c. In o I
24. Ordene los
siguientes elementos de menor a mayor energía de ionización: C, Si, Li y Ne
25. Para los elementos A y B cuyos números atómicos (Z) son 56 y 83
respectivamente, determinar:
a. Nombre de cada elemento, configuración electrónica condensada, en
orbitales, gas noble y mencione si cada elemento es paramagnético o diamagnético.
d. Conjunto de números cuánticos para
los electrones 40,41 del elemento A y para los electrones 51,52 del elemento B.
26. A continuación se da la configuración de un elemento.
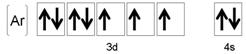
a. ¿Cuál es la identidad de este
elemento?
b.
Diga si una muestra del elemento será paramagnética o diamagnética.
c.
¿Cuántos electrones desapareados tiene un ión +3 de este elemento?
27. El litio es un metal blando
y ligero. Su estructura electrónica es 1s 2 2s 1. ¿Cuál de las siguientes afirmaciones es correcta?
a) Al formar un enlace toma un
electrón para alcanzar la estructura 1s2 2s2.
b) 2s1 representa el electrón de
valencia.
c) El ion litio es 1s2
2s3.
d) Su máximo grado de oxidación
es +3.
28. Considerando el átomo de Ne
y el catión Mg 2+:
a) Ambos tienen el mismo número
de protones.
b) Los dos tienen el mismo número
de electrones.
c) El tamaño del catión Mg2+
es mayor que el del átomo de Ne.
d) Ambos tienen el mismo número
de electrones que de protones.
29. P y Q son átomos de distintos
elementos situados en el mismo período y que tienen 5 y 7 electrones de valencia, respectivamente. ¿Cuál de las siguientes
afirmaciones es correcta respecto a dichos átomos?
a) P tiene una mayor primera energía
de ionización que Q.
b) Q tiene menor afinidad electrónica
que P.
c) P tiene mayor radio atómico
que Q.
d) El enlace P-Q será apolar.
30. ¿En cuál de los siguientes
elementos debe ser menor el valor de la primera energía de ionización?
a) Mg b) Al c) Si
d) P
31. Si un átomo de cierto elemento
posee la siguiente configuración electrónica:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 se puede decir que:
a) Es un metal de transición.
b) Se encuentra en un estado excitado.
c) Pierde un electrón con facilidad.
d) Es más electronegativo que el
yodo.
32. De acuerdo a las estructuras
de Lewis, que tipo de enlace tienen los siguientes compuestos:
a).- RbCl b).- SiCl
c).- Ca2SO4
33. Dibuje la estructura de Lewis
para los siguientes moléculas o iones:
a. NF3
b. HOBr c.
CLO3-
d. SO32-
e. CHClF2
f. BrF3 g. I3-
34. Ilustres las posibles estructuras
de resonancia para cada uno de las siguientes moléculas o iones:
a. SO2
b. NO2- c. SCN-
35. Para los siguientes compuestos: CO3-2, CH3COOCH3, H2PO4-, CLO3-,
CaBr2
Realice:
a) Escriba la estructura de Lewis y de resonancia (según el caso)
b) Determine la carga formal.
c) Señale los tipos de enlace químico presente
en cada uno de los compuestos.
GUÍA DE EJERCICIOS QUÍMICA GENERAL - UNIDAD II
1. El estudiante A realiza cuatro
mediciones del diámetro de una moneda con una herramienta de precisión llamada micrómetro. El estudiante B mide la misma moneda
con una regla de plástico simple. Los reportes son los siguientes:
|
Estudiante A |
Estudiante B |
|
28,246mm |
27,9 |
|
28,244 |
28,0 |
|
28,246 |
27,8 |
|
28,248 |
28,1 |
Determine el valor promedio y la desviación para cada conjunto de datos. Concluya sobre los
resultados de cada estudiante. El valor verdadero o real es 28,451
2. Verifique que la masa atómica
del Li sea 6,94, tomando en cuenta la siguiente información: la masa del 6Li= 6,015121 uma y posee una abundancia porcentual en la naturaleza de 7,50 %, mientras que la masa del 7Li = 7,016003 uma y posee una abundancia porcentual en la naturaleza de 92,50 %.
3. El galio tiene dos isótopos
naturales: 69Ga y 71Ga, como masas de 68,9257 y 70,9249 uma, respectivamente. Calcule las abundancias porcentuales de estos isótopos
de galio.
4. Calcule la masa en gramos de:
a. 2,50 moles de aluminio.
b. 1,24x10-3 moles de hierro.
c. 0,015 mol de calcio.
d. 653 moles de neón.
5. Calcule la cantidad de moles
que representan cada uno de lo siguiente datos:
a. 127,08 g de Cu.
b. 0,0120
g de Li.
c. 5,0 mg de As.
d. 6,75
g de Al.
6. Si se tiene 7,89 mg del elemento
gaseoso criptón, ¿A cuántos moles equivales esto? ¿A cuántos átomos?
7. Calcule la masa molar de cada
uno de los siguientes compuestos:
a) Oxido de hierro (III).
b) Tricloruro de boro.
c) Ácido Ascórbico (vitamina C,
C6H8O6)
8. Calcule la masa molar de cada
uno de los siguientes compuestos:
a) Fe(C6H11O7)2, gluconato de hierro (II),
un complemento dietético.
b) CH3CH2CH2CH2SH, butanotiol, de olor similar al del zorrillo.
c) C29H24N2O2, quinina, se emplea como medicamento
contra el paludismo.
9. Calcule la masa molar de cada
compuesto hidratado.
a) Ni(NO3)2.6H2O
b) CuSO4.5H2O
10. Determine el peso molecular
y composición porcentual de los siguientes compuestos:
a. CaC2O4
b. C6H5CHO
c. Co(NH3)5(NO2)Cl2
d. K4Fe(CN)6
11. La acetona, CH3COCH3, es un disolvente industrial importante. Si se producen
anualmente 1260 millones de kg de éste compuesto orgánico, ¿Qué cantidad de moles se produce?
12. Una tableta de Alka-Seltzer
contiene 324 mg de aspirina (C9H8O4), 1904 mg de carbonato ácido de sodio y 1000 mg de ácido cítrico (C6H8O7) (estos dos últimos compuestos reaccionan entre sí para
producir las burbujas de CO2, cuando se coloca la tableta en agua)
a. Calcule la cantidad (moles)
de cada sustancia en la tableta.
b. Al tomar una tableta ¿Cuántas
moléculas de aspirina se consumen?
13. Calcule la composición porcentual
de los siguientes compuestos:
a. Sulfuro de plomo (II)
b. Propano (C3H8)
c. C10H14O, carvona, compuesto encontrado
en el aceite de semillas de alcaravea
14. Se desea obtener 10.0 g de cobre metálico a partir de sulfuro de cobre (II). ¿Qué masa de
CuS será necesario emplear?
15. El mineral ilemita, FeTiO3, es una fuente de titanio.
¿Qué masa de ilemita en gramos se requiere para obtener 750 g
de titanio?
16. Calcule el porcentaje en masa
de oxigeno en cada uno de los compuestos siguientes:
a. SO2
b. Sulfato de sodio
c. C2H5COOH
d. Al(NO3)3
e. Nitrato de Amonio.
17. Calcule las cantidades siguientes
a. Masa, en gramos, de 1,73 moles
de CaH2
b. Moles de Mg(NO3)2 en 3.25
g de sustancias
c. Número de moléculas en 0,0772 moles de HCHO2
d. Número de iones NO3-
en 4,88 x 10-3 moles de Al(NO3)3
e. Masa, en gramos de 2,50 x 10-3
moles de sulfato de aluminio
f.
Moles
de iones cloruros que hay en 0,0750 g de cloruro
de aluminio
g. Masa, en gramos, de 7,70 x
1020 moléculas de cafeína, C8H10N4O2
h. Masa molar del colesterol si
0,00105 moles pesa 0,406 g
18. ¿Qué significa el término proporción
molar equivalente estequiométricamente y cómo se aplica para resolver problemas?
19. Los porcentajes de rendimientos
se calculan generalmente a partir de las cantidades de masa ¿Podría obtenerse el mismo resultado si se usaran cantidades de
moles? ¿Por qué?
20. La fórmula molecular de la
alicina, el compuesto que produce el olor característico del ajo, es C6H10OS2. ¿Qué masa
molar tiene la alicina? ¿Cuántos moles de alicina están presentes en 5,00 mg de ésta sustancia? ¿Cuántas moléculas de alicina
hay en 10,00 mg? ¿Cuántos átomos de azufre están presentes en 7,00 mg de alicina?
21. El nivel permisible de concentración
de cloruro de vinilo, C2H3Cl, en la atmosfera de una planta química es de 2,0 x 10-6 g/L. ¿Cuántos moles de cloruro de vinilo por litro
representa esta concentración? y ¿Cuantas moléculas hay en un litro?
22. Escriba la fórmula molecular
de cada uno de los siguientes compuestos
a. Fórmula empírica CH2, masa molar = 84 g/mol
b. Fórmula empírica NH2Cl, masa molar = 51,5 g/mol
23. Complete la siguiente tabla
|
Fórmula Empírica |
Masa molar(g/mol) |
Fórmula Molecular |
|
CH |
26,0 |
|
|
|
|
HClO2 |
|
|
|
C16H32 |
|
CHO |
232,0 |
|
24. Una gran familia de compuestos
que contienen boro e hidrógeno tiene la formula general BxHy. Un miembro de ésta familia contiene 88,5 % de B y el resto de
hidrógeno. ¿Cuál de las siguientes será su fórmula empírica: BH2, BH3, B2H5, B5H7 o B5H11?
25. Los reactivos D y E forman
el producto F. Escriba un plan detallado para encontrar la masa F que se forma cuando 5,0 g de D reaccionan con 8,0 g
de E.
26. Si la sal de Espom, MgSO4.XH2O se calienta a 250 ºC pierde toda
su agua de hidratación. Al calentar una muestra
de 1,687 g del hidrato se obtienen 0,824 g de MgSO4 ¿Cuántos moléculas de agua tiene cada unidad de MgSO4?
27. Al quemar 1,125 g de un hidrocarburo líquido CxHy, se produjeron 3,447 g de CO2 y 1,647 g H2O. En otro experimento se determinó que la masa molar del
compuesto era 86,2 g/mol. Determine las fórmulas empírica y molecular del hidrocarburo desconocido.
28. El cinc metálico (2,50g) se
combina con 9,70 g
de yodo para producir yoduro de cinc, ZnxIy ¿Cuál es la fórmula de este compuesto iónico?
29. Se combinan 1,25 g de Germanio con un exceso
de Cloro, Cl2. La masa del producto, GexCly, es 3,69 g. ¿Cuál es la fórmula del producto?
30. El porcentaje en peso de oxigeno
de un óxido de fórmula MO2 es 15,2%. ¿Cuál es la masa molar de éste compuesto? ¿Qué elemento o elementos podrían ser M?
31. Se sabe que un óxido tiene
de fórmula M2O5. En su forma pura, este compuesto
contiene un 75,27% de M en peso. ¿Cuál es el peso atómico de M?
32. Escriba la fórmula empírica
de cada uno de los siguientes compuestos dado que una muestra contiene
a. 0,01300 moles de C; 0,03900
moles de H y 0,00650 moles de O
b. 11,6
g de hierro y 5,01 g de Oxigeno
c. 40,0% de C; 6,7% de H y 53,3% de oxigeno.
33. Que masa de dióxido de azufre, contendrá
la misma masa de oxigeno contenido en 33,7 g de pentoxido
de diarsénico.
34. Una muestra de 20,822 g de un compuesto iónico contiene 6,072 g de Na, 8,474 g
de azufre y 6,336 g de oxigeno, determine cual es
la formula del compuesto.
35. Un compuesto formado por azufre y oxigeno
es un contaminante, responsable de la lluvia acida. Un análisis de una muestra del compuesto revela la siguiente composición
50,1 % de azufre y 49,9 % de oxigeno. ¿Cual es su formula empírica?
36. Un compuesto químico tiene
la siguiente composición centesimal: 40,2% de K; 26,9% de Cr y 32,9% de O. ¿Cuál es la fórmula empírica?
37. ¿Cuál es la fórmula de un compuesto si en 4,28 g del mismo hay 1,44 g
de Cu; 0,64 g de N y el resto O?
38. Dada la siguiente reacción química.
Ca(OH)2 + SO2 ® Ca(HSO3)2
Determine la masa en g, de sulfito ácido de calcio obtenida al hacer reaccionar 64,8 g de hidróxido de calcio con 52,4 g de
dióxido de azufre.
39. El tetracloruro de titanio se oxida en presencia de oxigeno dando como producto dióxido de titanio y cloro:
TiCl4 + O2
® TiO2 + Cl2
Determine la pureza del tretracloruro de titanio empleado si al hacer reaccionar 4.00 toneladas de TiCl4 en exceso de oxigeno se obtuvo 1.4 ton de dióxido de titanio. (Suponga 100% de
rendimiento).
40. El metano, CH4,
se quema con oxigeno.
a. ¿Cuáles son los productos de
la reacción de combustión completa?
b. Escriba la ecuación balanceada
de la reacción
c. ¿Qué masa de O2,
en gramos, se requiere para la combustión total de 25,5 g
de metano?
d. ¿Cuál es la masa total de productos
que se esperaría obtener de la combustión de 25,5 g
de metano?
41. El compuesto SF6 se obtiene quemando azufre
en una atmosfera de flúor. La ecuación es:
S8 (s)
+ F2 (g) à SF6 (g)
Si se emplean 1,6 moles de azufre, S8, y 35 moles de F2, ¿Cuál es el
reactivo limitante?
42. La aspirina, C9H8O4, se produce haciendo reaccionar
el ácido salicílico, C7H6O3, con anhídrido acético, C4H6O3.
C7H6O3 (s) + C4H6O3
(l) à C9H8O4 (s) + CH3CO2H (l)
Si se mezclan 100 gramos
de cada uno de los reactivos ¿Cuál es la masa máxima de aspirina que se podrá obtener?
43. A altas temperaturas el NaHCO3 se transforma en Na2CO3.
NaHCO3 (s) à Na2CO3 (s) + CO2 (g) + H2O (g)
Al calentar una muestra de 0,7184 g
de carbonato ácido de sodio impuro, se desprende Na2CO3 ¿Cuál era el porcentaje en masa de NaHCO3
en la muestra original?
44. El estireno, unidad constitutiva
del poliestireno, es un hidrocarburo formado únicamente de C y H. Si se queman 0,438 g de estireno con oxigeno y se obtienen 1,481
g de CO2 y 0,303 g de H2O, ¿Cuál es la fórmula empírica del estireno?
45. El azuleno es un hidrocarburo
de color azul, CxHy. Si se queman 0,106 g de éste compuesto con oxigeno se obtienen 0,364 g de CO2 y 0,0596 g de H2O. ¿Cuál es la fórmula empírica
del azuleno? En otro experimento se obtuvo que la masa molar del compuesto es de 128,2 g/mol ¿Cuál es su fórmula molecular?
46. El KClO4 puede obtenerse mediante la siguiente serie de reacciones:
Cl2 + KOH
→ KCl + KClO + H2O
KClO
→ KCl + KClO3
KClO3
→ KCLO4 + KCl
Calcule la masa de KOH para preparar 250,0 g de KCLO4
47. ¿Cuántos gramos de Al2(CO3)3
se obtiene a
partir de 10 g de Al2O3 y 15,0
g de CO2? ¿Cuál es el reactivo limitante? ¿Qué sustancia y que cantidad de ella que queda sin reaccionar?
48. Muchos metales reaccionan con
el oxígeno para formar el óxido metálico. Por ejemplo, el calcio reacciona como sigue:
Ca (s) + O2 (g) →
CaO (s)
Se desea calcular la masa del óxido de calcio que puede prepararse a partir de 4,20 g y 1,60 g,
cuantos moles de CaO pueden producirse de la masa dada de Ca. ¿Cuál es el reactivo limitante?, Rendimiento teórico del CaO.
49. Se desean preparar 0,18 moles
de un compuesto C mediante la serie de reacciones:
A
→ B
4B →
C
El primer paso de la serie tiene un rendimiento
del 91 %, el segundo 72 %. Con cuantos moles de A se debe iniciar el proceso.
50. Al calcinar 2 toneladas de
piedra caliza (CaCO3) se obtuvieron 990 Kg de cal viva (CaO). Determine: a) rendimiento real, b) rendimiento teórico, c) rendimiento en porcentaje para
el CaO
51. Balancee las siguientes ecuaciones
por tanteo y nombre cada uno de los compuestos involucrados:
a. SO2 (g) + O2(g) → SO3 (g)
b. P4O10(s)
+ H2O (l) → H3PO4
(l)
c. H3PO4
(l) + NaOH → Na2HPO4 (ac)+ H2O(l)
52. Convierta los siguientes enunciados
siguientes en ecuaciones balanceadas:
a. El galio metálico se calienta en presencia de gas oxigeno, se funde y forma óxido de galio
(III) que es sólido.
b.
Se mezcla soluciones de cloruro de calcio
y fosfato de sodio, se forma fosfato de calcio sólido y el cloruro de sodio permanece en solución.
53. Cuando el hidróxido de hierro (II) reacciona
con el acido fosfórico bajo la reacción:
Fe(OH)2 + H3PO4
→ Fe3(PO4)2
+ H2O
Para producir Fe3(PO4)2 y agua. Si reaccionan 12,00 g de
hidróxido de hierro (II) con 6,52X10-1
Kg de ácido fosfórico, determine:
a) La ecuación balanceada que representa la reacción.
b) La cantidad de Fe3(PO4)2 en gramos que se puede producir.
c) La masa del reactivo en exceso (gramos) al finalizar la reacción
d) Si se obtienen 0,023 lb de Fe3(PO4)2, cual es el rendimiento porcentual.
e) La masa
(Kg) de H2O que se puede obtener.
54. Balancee las siguientes ecuaciones
por el método de ión electrón y nombre cada uno de los compuestos involucrados
a.
MnO4- + Br → MnO2- + BrO3-
b. I2 + KOH →
KIO3 + KI
c. Zn + NaNO3 + NaOH → Na2ZnO2 + NH3 + H2O
55. Escriba ecuaciones balanceadas para las siguientes
semirreacciones y especifique si se trata de una oxidación o de una reducción.
a.
Cr (s) à Cr3+
(en ácido)
b. AsH3 (g) à As (s)
(en ácido)
c.
VO3- (ac) à V2+ (en ácido)
d.
Ag (s) à Ag2O (s)
(en base)
56. Balance las siguientes reacciones REDOX que
ocurren en soluciones ácida.
a. Ag (s)
+ NO3- (ac)
à NO2 (g) + Ag+ (ac)
b.
Zn (s) + NO3- (ac) à Zn2+ (ac) + N2O
(g)
c.
Cr (s) + NO3- (ac) à Cr3+ (ac) +
NO (g)
57. Balancee las siguientes ecuaciones en medio
básico
a. Fe(OH)3 (s) + Cr (s)
à Cr(OH)3 (s) +
Fe(OH)2 (s)
b. NiO2
(s) + Zn (s) à Ni(OH)2 (s) + Zn(OH)2 (s)
c. Fe(OH)2
(s) + CrO42-
(ac) à
Fe(OH)3 (s) + Cr(OH)4- (ac)
d. Cl2 + KOH → KCl + KClO3 + H2O
e. CrI3 + KOH + Cl2 → K2CrO4 +
KIO4
+ KCl + H2O
f. PbO2 + Sb + KOH → PbO + KSbO2 + H2O
g. KClO3 + HI + H2SO4 → KHSO4 + HCl + I2 + H2O
h. KBrO3 + KI + HBr → KBr + I2 + H2O
GUÍA DE EJERCICIOS QUÍMICA GENERAL
UNIDAD III: Liquidos y Soluciones
1. ¿El agua a una presión de 1,1 atm hervirá a 100ºC?
Explique
2. ¿Por qué el vapor de agua a 100ºC
causa quemaduras más severas que el agua líquida a 100ºC?
3. Determine el calor molar de vaporización del agua a 30
ºC con los siguientes datos: Presión de vapor del H2O es 30,04 torr a 29ºC, Presión de vapor
del H2O es 33,70 torr a 31ºC.
4. Calcule el punto de ebullición del agua a 570 torr. ∆Hv = 9,7 Kcal/mol (Se considera constante entre 90ºC y 102ºC)
5.
El punto de ebullición normal de etanol es 78,3ºC
y su calor molar de vaporización es 39,3 kJ/mol. Determine la temperatura a la cual hierve el etanol en un refugio de una
montaña en donde la presión atmosférica es de 600 mmHg.
6. De los siguientes datos, calcular el calor total (en J) necesario para convertir 12 g de hielo a -5ºC
en agua líquida a 0,5ºC. Punto de fusión a 1 atm 0ºC,
Cpsolido = 2,09 J/g ºC, Cplíquido 4,21 J/g ºC, ∆Hºfus = 6,02 KJ/mol.
7. ¿Cuánto calor es requerido para convertir 75.0 g
de etanol (C2H5OH) a -120 ºC
a la fase vapor a 78 ºC ? y ¿Cuál seria su diagrama
de calentamiento?. Si el etanol funde a -114 ºC y ebullé a 78 ºC.
La entalpía de fusión del etanol es de
5.02 KJ/mol , y su entalpía de vaporización es de 38.56 KJ/mol . Los calores específicos del etanol sólido, líquido
son 0.97 J/gºC y 2.3 J/g ºC, respectivamente, para el grafico suponga una
variación en el tiempo.
8. ¿Cuál es el calor de vaporización de un líquido que tiene una presión de vapor de 641 torr a 85,2 ºC y un punto de ebullición a 95,6 ºC a 1 atm?.
9. Los puntos normales de fusión y ebullición del Xenón son -112 ºC y -107
ºC, respectivamente. Su punto triple esta a -121
ºC y 0.4 atm y su punto critico
16.6 ºC y 57.6 atm. Dibuje el diagrama de
fase del Xe, mostrando los cuatro puntos dados aquí e indicando el área en cada fase. Si Xe gaseoso se enfría bajo presión
externa de 100 torr, se condensa o se deposita?
10.
Usar los siguientes datos para dibujar el diagrama de fase cualitativo para el etileno: Punto de ebullición a 1 atm es 169
K, punto de fusión a 1atm es -169,16
ºC, punto crítico 9,9 ºC
y 742 psia, punto triple -169,17
ºC y 1,20 x 10-3 atm. Señale sobre este diagrama los procesos
de evaporación, fusión, congelación, sublimación, deposición y una mezcla sólido-líquido. Como representaría las variaciones de las propiedades coligativas sobre este diagrama.
11. Calcule el % p/p de una solución que se prepara agregando 7 gramos de NaHCO3 a 100 gramos
de agua.
12 Una muestra de 5 mL de sangre contiene 0,00812
gramos de glucosa, calcule el % p/v de la muestra.
13 Una muestra de vinagre contiene 6,10 % p/p de ácido acético. ¿ Cuantos gramos de ácido acético están
contenidos en 0,750 litros de vinagre?. La densidad
del vinagre es 1,01 g/mL.
14. Determinar el % p/p o p/v según corresponda a las siguientes soluciones:
a) 5,0 g de NaOH disueltos en H2O,
dando 200 g de solución. b) 2,5 g de KCl en 80 g
de H2O. c) 0,25 g de fenolftaleína en suficiente
alcohol para obtener 50 mL de solución.
15. ¿Qué Molalidad tiene una muestra de 100 mL de H2O de
mar, en la que se encontraron 2,58 g de NaCl?. ( densidad
H2O de mar = 1,5 g/mL)
16. Calcule la Molaridad resultante de 50 mL
de una solución 0,2 M de NaOH a la cual se la han vertido
50 mL de H2O destilada.
17. Calcule la fracción molar y el % p/p de una solución preparada disolviendo 0,3 moles de CuCl2 en
720,6 gramos de H2O.
18. ¿Qué Molaridad tendrá una solución resultante cuando 0,750
L de NaOH 0,672 M se diluya
a un volumen de 1,8 L?
19. Para una solución acuosa saturada en cada uno de los siguientes casos, a
20ºc y 1 atm, ¿la solubilidad se incrementará, disminuirá o permanecerá igual cuando ocurra el cambio indicado? A)
He(g) disminuye la T, B) NaOH (s) ∆Hsol < 0 y se incrementa
la T.
20. El permanganato de potasio tiene una solubilidad de 6,4 g
/100 g de H2O a 20 ºC y calor de
solución positivo. ¿Cómo prepararía una solución sobresaturada de permanganato de potasio?
21. ¿Qué volumen de HNO3 0,109M, en mililitros, se requiere para que reaccione totalmente con 2,50 g de Ba(OH)2?
HNO3 (ac) + Ba(OH)2 (s) → H2O(l) +
Ba(NO3)2 (ac)
22. Cuando se hace pasar una corriente eléctrica a través de una solución acuosa de NaCl, se obtiene H2(g),
Cl2(g) y NaOH.
NaCl (ac) + H2O(l) → H2 + Cl2(g) + NaOH (ac)
¿Qué masa de NaOH puede producirse a partir
de 15 L de NaCL 0,35M? ¿Qué masa de cloro puede obtenerse?
23. Se tiene 0,954 g de un ácido desconocido,
H2A, que reacciona con NaOH según la ecuación balanceada:
H2A (ac) + 2 NaOH (ac) → Na2A(ac) + 2 H2O(l)
Se requiere 36,04 ml NaOH 0,509M para titular el ácido hasta su punto de equivalencia,
¿Cuál es la masa molar del ácido?
24. Se hacen reaccionar 421 g
de Hidróxido de Calcio ( Ca(OH)2) con 8,2x10-1 L de una solución ácido nítrico ( HNO3)
al 3,05M , bajo una reacción de neutralización o reacción acido-base:
Ca(OH)2 + HNO3 (ac)
→ ????? + ??????
Determine:
a) La ecuación balanceada de la reacción (complete
la reacción y balancee)
b) Quien es el reactivo limitante y reactivo
en exceso
c) La masa en gramos de los productos que se
forma
d) Masa
en gramos del reactivo en exceso.
e) Rendimiento
teórico en Kg
25.¿Cuál es el punto de congelación de una solución de urea 0,111
m en agua?
26.¿Cuál es la masa mínima de etilengicol (C2H6O2) que debe disolverse en 14,5 Kg de agua para prevenir que la solución se congele a -10,0 ºF
27.
Una solución acuosa hierve a 100,2 ºC ¿A
que temperatura congelará? Ke = 0,512 ºC/m
Kc = 1,86 ºC/m.
29. Al disolver 5g de una sal del tipo MA2 en H2O
se obtienen 2000 ml de una solución que ejerce una presión osmótica de 866 torr a 31ºC.
Suponiendo que la sal se ioniza totalmente calcule: a) Factor de Van Hoff. B) Molaridad de la solución. C) Peso molecular
de la sal.
30.
Describa el procedimiento para preparar 500 ml de una solución al 20% p/p a partir Na2SO4 sólido. Para
esta solución determine la concentración expresada en: % p/v, Molaridad, Normalidad, Molalidad, fracción molar de soluto y
solvente, si la densidad de la solución resultante es 1,13 g/ml. Determine la temperatura de ebullición, congelación (Sugerencia
utilice la variación de las propiedades coligativas ΔTc, ΔTe)
Ke = 0,512 ºC/m
Kc = 1,86 ºC/m.
31. Se dispone de una solución acuosa 0,6 M
de NaOH, d = 1,08 g/mL. Determine su concentración expresada en:
a) % p/v b) % p/p c) m
d) N
e) Xs
32. Usted posee una solución 20 % p/p de NaCl, d = 1,3 g/mol. Exprese su concentración en:
a)
M
b) % p/v c) N d) m e)
Xs
33. Se tiene una solución 10 % p/v de KCl, d = 1,06 g/ml. Determine su concentración expresada en:
a)
M
b) % p/p c)
m
d) N e) Xs y
Xd
Guía de ejercicios - Química General
Unidad IV. Gases
Conversiones
1. Transforme una presión de
635 mmHg a su valor correspondiente en atmósfera (atm), bar y kilopascales (kPa)
2. Clasifique las siguientes
presiones de mayor a menor magnitud: 75 kPa, 250 mmHg, 0,83 bar y 0,63 atm.
3. Determinar la presión en N/m2, sobre
un punto sumergido a 6,00 m. de profundidad en una masa de agua. Densidad del agua: 1,000 g/cm3
4. Convertir una altura de presión de 5 m. de agua
(Densidad del agua: 1,000 g/cm3), en altura de aceite de densidad 0,750 1,000 g/cm3
5. Un medidor de vacío conectado a un
tanque registra 30 kPa en un sitio donde la lectura barométrica es de 755 mmHg . ¿cuál es la presión absoluta en el tanque?
6. Un cilindro de oxígeno contiene
1 pie3, a 70ºF y 200 lb-f/plg2
man. ¿Cuál será el volumen de este O2 en un recipiente a 90ºF,
una presión de 4 plg de H2O mayor que la atmosférica? La presión barométrica es de 29,92 plg de Hg.
7. Una muestra de nitrógeno
gaseoso en la bolsa de aire de un automóvil o airbag con volumen de 65,0
L, tiene presión de 745 mmHg. Si se transfiere esta muestra a una bolsa de 25,0 L a la misma temperatura, ¿Cuál será la presión del gas en la nueva bolsa?
8. Supóngase que se lanza un
globo lleno de helio cuando hay una temperatura de 22,5 ºC
y una presión barométrica de 754 mmHg. Si el volumen del globo es 4,19X103 L ¿Qué volumen tendrá a una altitud
de 20 millas, donde la presión es 76,0 mmHg y la
temperatura es -33,0 ºC?
9. Una muestra de CO2
tiene una presión de 56,5 mm Hg en un matraza de
125mL. Si la muestra se transfiere a otro Matraz donde tiene la presión de 62,3 mm Hg. ¿Cuál es el volumen del nuevo matraz?
10. Antes de salir de viaje en automóvil, se recomienda
revisar las condiciones del vehiculo: gasolina, aceite, agua del radiador y aire de los cauchos. Antes del estacionamiento,
una persona revisa el aire de los cauchos utilizando un pequeño manómetro y determina que la presión es 38 psi, la temperatura
ambiente en ese momento es 22 o C. Luego de viajar durante 3 horas se detiene en una estación de gasolina y mide
la presión de los cauchos, al hacerlo se da cuenta que los cauchos tienen una temperatura de 80 o C. Si se considera
que el volumen de los cauchos no varia de manera significativa ¿Qué presión tenían los cauchos cuando se detuvo en la estación
de gasolina? (1atm= 14,70 lb/pulg2)
11. Se tiene 3500 cm3 de NO a temperatura
de 71,6 ºF. ¿Qué volumen ocupará el NO a 37,0 ºC?
12. Una muestra de 0,3051 in3 de CO2 gaseoso
se encuentra dentro de una jeringa bien sellada a 22,0 ºC.
Si se sumerge la jeringa en un baño de hielo (0 ºC),
¿Cuál será el nuevo volumen de gas?
13. Un gas liberado durante la fermentación de glucosa
(elaboración de vino) tienen un volumen de 780 cm3 cuando se mide a 20 o C y 750 torr ¿Cual será el
volumen del gas (en litros) a la temperatura de 36 o C y la presión de 0,960 atm?
14. Un globo utilizado para evaluar las condiciones
atmosféricas se llena con helio a una temperatura de 22 o C, la presión atmosférica al momento de llenarlo era
700 torr. El globo comienza a elevarse lentamente hasta una altura en la cual la presión atmosférica es 620 torr y la temperatura
11 o C. El volumen del globo al momento de llenarse era 20 cm3.
a. Determine la masa de gas (en gramos) que contenía el globo después
de llenarlo, antes de comenzar su ascenso.
b. Determine el volumen del globo luego de su ascenso.
c. Debido a una fuerte ráfaga el globo continua elevándose si control
hasta una altitud en la cual explota, explique la razón de la explosión.
15. El nitrógeno se encuentra dentro de un tanque de
acero inoxidable de 20 litros a una temperatura
de -21 o C y ejerce una presión de 10,1 atm.
a. ¿Cuantos moles de gas contendrá el tanque?
b. ¿Qué presión ejercerá el gas si se calienta hasta 0 o
C?
16. Un buceador llena un globo con aire de un tanque
a una profundidad en la cual la presión del agua es 2 atm y la temperatura 6 o C, el volumen del globo es 750 cm3,
una vez lleno de aire el buceador suelta el globo.
a. Determine el volumen del globo al llegar a la superficie del
mar si la temperatura era 25 o C.
b. Si el aire del taque esta constituido por oxígeno y nitrógeno
y la presión parcial del oxígeno dentro del globo al momento de soltado es 0,2 atm, determine la masa del aire que contenía
el globo.
17. Se tiene una muestra de CO2 en un matraz
A con volumen de 1.525 in3. A 20,5 ºC,
la presión del gas es de 436,5 mmHg. Para determinar el volumen de otro matraza (B) se pasa el CO2 al mismo y se determina
que su presión es ahora de 0,12408 atm a 24,5ºC. ¿Qué volumen tiene el matraz B?
18. Un globo aerostático contiene 1,2 x 107 L de Helio. Si la presión de helio es de 0,9826 bar a 25ºC. ¿Qué masa en gramos de Helio contiene el globo?
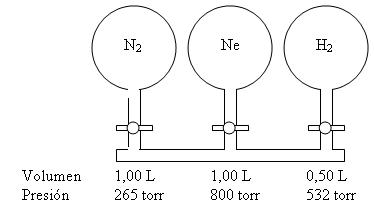
19. Considere el sistema de matraces que se muestra
en la ilustración. Cada matraz contiene el gas al volumen y presión señalados. Calcule la presión del sistema si se abren
todas las válvulas de paso. Podemos hacer caso omiso al volumen de los tubos que conectan a los matraces.
20.
Un
compuesto organofluorado gaseoso tiene una densidad de 2,216x10-2 lb/ft3 a 17ºC
y 189 mmHg. ¿Cuál es la masa molar del compuesto?
21.
Un cilindro de gas comprimido
dice “composición (%molar): 4,50% H2S, 3,00% CO2 y el balance de N2” El calibrador
de presión del cilindro indica una presión de 46,0 atm. Calcule la presión parcial de cada gas, en mmHg, dentro del cilindro.
22.
Algunos destapadores de cañería
contienen dos componentes: hidróxido de sodio y polvo de aluminio, cuando la mezcla se vacía en un drenaje tapado ocurre la
siguiente reacción:
NaOH
+ Al +
H2O à NaAl(OH)4 +
H2
El calor
generado en esta reacción ayuda a derretir las obstrucciones de grasa y el hidrogeno gaseoso remueve los sólidos destapando
el drenaje. Determine el volumen de hidrogeno producido a 1 atm y 27 o C, si se añade a un drenaje una mezcla de 3,12 g de Al en polvo y exceso de NaOH.
23.
En la industria de alimentos se
utilizan algunos compuestos químicos como leudante, estas sustancias se descomponen durante el proceso de horneado produciendo
gases que levantan el alimento, obteniéndose un efecto esponjoso. En la elaboración de ciertos tipos de galletas se utiliza
el bicarbonato de amonio que se decompone por calentamiento según la reacción:
NH4HCO3 à NH3(g) +
CO2 +
H2O
Este leudante deja ningún residuo en el alimento ya que se gasifica completamente. Durante un experimento
se someten a calentamiento 125 g de este leudante,
determine el volumen total de los gases obtenidos a esta temperatura y 690 torr.
24. Cierto
gas, cuya masa molar se quiere determinar, experimenta efusión a través de una apertura a una velocidad que equivale a la
tercera parte de la del gas helio. ¿Cuál es la masa molar del gas desconocido?
25. Una
muestra impura de KClO3 tiene una masa de 30 g,
para analizarla se calienta hasta su descomposición según la reacción química:
KClO3(s) à KCl(s) +
O2(g)
El
oxigeno liberado es recogido sobre agua y ocupa 9,72 L
a 0,9 atm y 25 oC.
a. Determine el porcentaje de pureza de KClO3
en la muestra original.
b. Determine el volumen que ocupara el oxígeno en condiciones
normales.
26. En
el laboratorio se prepara un sistema como el siguiente:
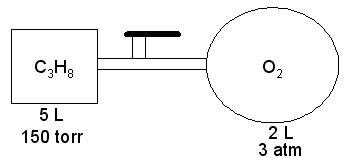
La temperatura
a la cual se lleva a cabo el experimento es 20 oC.
a. Determine la presión parcial del gas a presión
final del sistema luego de abrir la llave de paso que comunica ambos recipientes.
b. Determine la presión parcial de cada gas si se hace
saltar una chispa para que ocurra la siguiente reacción a temperatura ambiente:
C3H8(g) + O2 à CO2 +
H2O(l)
27. En
el laboratorio se analiza un gas tóxico formado por 46,2 % de C y 53,8 % de N, una muestra de 0,05 g
del gas a 25 oC ocupa 0,5 L, determine la
formula del gas tóxico.
28. Se
desea almacenar 165 g de gas CO2 en un tanque
12,5 L a temperatura ambiente (25 ºC). Calcule la presión que tendría el gas:
a. Con la ecuación de los gases ideales
b. Con la ecuación de Van der Waals, si a= 3,59 atm.L2/(mol2)
y b=0,0427 L/mol.
c. Con la ecuación del factor de comprensibilidad.
Sabiendo que Temperatura crítica y la presión crítica del CO2 son 31,1 ºC y 7382 kPa absolutas respectivamente.
29. En
un experimento se tiene una bombona con 0,16 kg de
metano y otra con 0,17 kg de gas amoniaco a 25 oC,
el volumen de cada una es 60 cm3.
a. Si se considera que ambos gases se comportan idealmente
¿Cuál será la presión de cada gas en su bombona respectiva?
b. Si se considera que ambos gases son reales ¿Cuál será
la presión que marcara el manómetro de cada bombona? Utilice los valores de a y b para las constantes de Van Der Waals de
la siguiente tabla:
|
Gas |
a (atmL2/mol2) |
b (l/mol) |
|
Metano |
2,25 |
0,0428 |
|
Amoniaco |
4,17 |
0,0371 |
c. Si se abren las llaves de ambas bombonas ¿Cuál
de ellas se vacía en menor tiempo? Justifique su respuesta por medio de la ley de Graham.
30. Durante
un experimento se utilizaron dos globos de u material poroso, los cuales se llenaron bajo las mismas condiciones, uno de ellos
con gas hilarante (N2O) y el otro con un gas tóxico, que es lacrimógeno, cada globo tenia un volumen de 5 L al comenzar el experimento. El globo con gas hilarante se desinfló en
130 segundos y el otro en 215,6 segundos.
a. Determine la masa molar del gas tóxico.
b. Una persona que estaba en la puerta del laboratorio
al comenzar el experimento, presenta cierto malestar después de cierto tiempo ¿que sentirá primero: un lagrímeo o ganas de
reírse sin motivo? Justifique su respuesta
31. Los clorofluorocarbonos tienen la formula empírica CHF2.
En un experimento se determina que una muestra de 0,1 g
de uno de estos compuestos ejerce una presión de 70,5 mmHg en un recipiente de 256 ml a 22,3 ºC ¿Cuál es la masa molar del compuesto?¿Cuál es su fórmula molecular?
32. Le piden que diseñe una bolsa de aire para un automóvil o airbag.
Sabe que debe llenarse con un gas con presión más alta que la atmosférica, por ejemplo 829 mmHg, a temperatura de 22,0 ºC. La bolsa tiene un volumen de 45,5 L ¿Qué cantidad de azida de sodio NaN3, se deberá emplear para generar
la cantidad de gas necesaria? La reacción productora de gas es:
NaN3(s) à Na(s) + N2(g)
|